Физические свойства подземных вод
Физические свойства подземных вод
Особые свойства воды
Вода (оксид водорода) Н2О — простейшее и самое распространенное в природе устойчивое химическое соединение водорода с кислородом. В состав молекулы воды обычно входит водород с атомной массой 1 и кислород с атомной массой 16. Однако имеются изотопные разновидности воды, содержащие водород Н2 (дейтерий) и Н3 (тритий) и кислород О17 и О18 .
Из общего количества воды на обычную воду приходится 99,73 %. Кроме того, в подземных водах находятся растворенные вещества, диссоциированные на ионы, а также газы, коллоиды, бактерии, органические вещества и взвешенные частицы.
Вода обладает многими аномальными свойствами. Никакая другая жидкость не может сравниться с водой по числу веществ, которые могут в ней растворяться, и по количеству вещества, которое она может удерживать и переносить в растворе. Наибольшая плотность чистой воды — 1,00 г/см3 при температуре 4оС; при понижении и при повышении температуры — плотность уменьшается.
В зависимости от содержания солей вода имеет наибольшую плотность при различной температуре. Плотность морской воды — 1,03-1,08, концентрированных рассолов — 1,3-1,4 г/см3. При замерзании воды происходит увеличение объема, плотность льда 0,92 г/см3. По сравнению с другими веществами, вода отличается необычно высокой удельной теплоемкостью и удельной теплотой плавления.
Теплота ее испарения выше
теплоты испарения любых других жидкостей, а теплота кристаллизации уступает только аммиаку. Среди существующих в природе жидкостей, поверхностное натяжение воды уступает только ртути. Некоторые свойства воды изменяются под действием магнитного поля, что связано с перестройкой структуры воды.
Эффект магнитной обработки воды сохраняется несколько суток после снятия магнитного поля. Вода, нагретая до 400°С, после охлаждения остается некоторое время активизированной, т.е. сохраняет повышенную растворяющую способность. Талая вода лучше усваивается живыми организмами, причем это свойство сохраняется в течение нескольких десятков часов после таяния снега.
Гидростатическое давление подземных вод увеличивается на 1 ати. на каждые 10 м глубины. В некоторых районах подземные воды глубоких горизонтов находятся под значительно большим давлением, близким к геостатическому, т.е. давлению вышележащей толщи горных пород.
В таких условиях давление подземных вод возрастает на 2,3 ати. на 10 м глубины. Кипения подземных вод в глубоких водоносных горизонтах с температурой более 100°С не происходит, ибо при повышении давления резко возрастает температура кипения. Так, под давлением 10 ати. вода закипает при температуре 179оС. Такое давление подземные воды имеют на глубине около 100 м, где температура значительно ниже точки кипения.
Основные физические свойства подземных вод
Физические свойства подземных вод существенно зависят от их химического состава и содержания примесей.
Температура — изменяется в широких пределах и зависит от геологического строения, глубины залегания, физико-географических и климатических условий, режима и питания.
В области распространения многолетнемерзлых пород соленые воды имеют отрицательную температуру. В умеренном климате неглубоко залегающие подземные воды имеют температуру от 5 до 12°С. В областях молодого вулканизма температура подземных вод может превышать 100°С.
Температура воды существенно влияет на количество содержащихся в ней солей и газов. С повышением температуры растворимость большинства солей увеличивается, но некоторых — уменьшается. Классификация подземных вод по температуре: 0-20 — холодные, 20-37 — теплые, 37-100 — термальные, 100-374°С — перегретые (374°С — критическая температура, при которой исчезают различия физических свойств жидкости и пара).
Цвет — зависит от содержания некоторых химических и органических веществ. Сероводород и соли оксида железа 2 придают воде зеленовато-голубую окраску, а соли оксида железа 3 — ржавую, органические гуминовые кислоты окрашивают воду в желтый цвет, взвеси — в сероватый. В большинстве своем подземные воды бесцветны. Химически чистая вода — голубого цвета.
Прозрачность — способность воды пропускать световые лучи, зависит от содержания механических примесей, коллоидов, органических веществ, а также от количества растворенных в ней солей. Степень мутности определяется прибором. В основном подземные воды прозрачные.
Вкус — придают воде растворенные в ней вещества и газы. Хлориды натрия — соленый, сульфаты натрия и магния — горький, азотистые соединения и органические вещества — сладковатый, свободная углекислота — приятный, освежающий, ионы железа — неприятный.
Запах — обычно отсутствует, но иногда ощущается
Вода, богатая гуминовыми веществами имеет запах болота, сероводородом — запах тухлых яиц, мало разбираемая вода в старых колодцах с деревянным креплением — затхлый.
Приведенные физические свойства регистрируются при отборе воды из источника или скважины. Кроме того, при необходимости, определяются такие физические свойства как электропроводность, радиоактивность, плотность, вязкость.
Химический состав подземных вод
Подземные воды представляют собой сложные естественные растворы, находящиеся в многообразных связях с вмещающими их горными породами, органическими остатками, микроорганизмами и с другими составляющими окружающей среды. В подземных водах обнаружено более 80 химических элементов.
Ионный состав можно подразделить на главные ионы, которые всегда содержатся в подземных водах, второстепенные и микрокомпоненты, содержащиеся в ничтожном количестве. Главные ионы образуются в основном за счет растворения галоидных (каменная соль), сульфатных (гипс, ангидрит) и карбонатных (известняк, доломит) пород.
Из анионов это: Cl-, , (); из катионов: Ca+2, Mg2+, (Na++K+). Ионы и имеют единый генезис и находятся в неразрывной связи, определяемой факторами карбонатного равновесия, что позволяет рассматривать их совместно. Близость свойств Na+ и K+ также дает возможность рассматривать их вместе (калий в подземных водах составляет 4-10 % количества натрия). Таким образом, основной состав подземных вод рассматривается как шестикомпонентный.
К второстепенным ионам относятся: , , , H+, OH- и некоторые другие. Имеются в подземных водах и недиссоциированные соединения, чаще других встречаются: SiO2, Fe2O3, Al2O3. Микрокомпоненты — хотя и не определяют тип воды в виду малого их содержания, но оказывают влияние на специфические ее особенности, в частности, на течение биологических процессов. К микрокомпонентам относятся такие элементы, как Li, B, F, Ti, V, Cr, Mn, Co, Ni, Cu, Zn, As, Br, I, Sr, Mo, Rb.
Газы в подземных водах
могут находиться в растворенном виде и выделяться в свободное состояние в виде пузырьков при уменьшении давления, происходит и обратный процесс. Наиболее распространенными газами в подземных водах являются:
Кислород (О2) — попадает из атмосферы и выделяется некоторыми бактериями, быстро расходуется на окисление органических соединений, металлов и горных пород, в глубоких горизонтах не встречается.
Углекислый газ (СО2) — поглощается подземными водами из атмосферы, образуется при биохимических и химических процессах в подземных условиях, выделяется при вулканических извержениях; способствует растворению пород, количество его с глубиной убывает.
Сероводород (Н2S) — присутствует в подземных водах главным образом благодаря восстановлению сульфатов некоторыми видами бактерий в анаэробной среде.
Азот (N2) — попадает из воздуха, образуется при разложении органических веществ и при метаморфизации пород; инертен.
Метан (СН4) — в подземных водах образуется в результате биохимических процессов при разложении органических веществ на заболоченных территориях и в нефте-газоносных районах.
Водород (Н2) — накапливается в подземных водах в виде ионов в процессе диссоциации воды и при разложении органических веществ, а также при гидролизе солей тяжёлых металлов.
Коллоиды — наиболее часто встречающиеся в подземных водах — гидроксиды железа Fe(ОН)3 и алюминия Al(ОН)3 , кремнезем SiO2 и органические соединения. Эти вещества образуют неустойчивые коллоидные растворы (золи), которые выделяют коллоидно-растворенное вещество в виде гелей.
Органические вещества
Органические вещества широко распространены в подземных водах. Это гумусовые вещества, гумины, углеводороды, азот- и фосфорсодержащие вещества, битумы, фенолы, бензолы и др.
Микроорганизмы в подземных водах представлены различными бактериями, некоторые из них вредны для человеческого организма, поэтому для питьевой воды проводятся бактериологические исследования с целью санитарной оценки. О бактериальной загрязненности воды судят по колититру — объем воды в кубических сантиметрах, в котором содержится одна кишечная палочка, и по колитесту — число кишечных палочек в 1 л воды.
Реакция воды — определяется концентрацией диссоциированных в ней ионов водорода (Н+) и гидроксила (ОН-). В химически чистой воде при температуре 22оС содержание их определяется диссоциацией воды НО2 Û Н++ ОН- и они находятся в одинаковых количествах (Н+)=(ОН-)=10-7 г/л. Для характеристики реакции воды служит водородный показатель рН, который численно равен отрицательному десятичному логарифму концентрации ионов водорода, т.е. рН = -lg(Н+) = -lg(10-7) = 7. В природных водах концентрация ионов водорода зависит не только от диссоциации воды, а главным образом от протекающих в них реакций, в связи с чем соотношение ионов водорода и гидроксила меняется и становится не равным. По величине водородного показателя воды делятся на кислые (рН7).
Жесткость — особое качество воды, которое придают ей ионы кальция и магния. Различают общую, временную и постоянную жесткость воды. Общая жесткость обусловлена суммарным содержанием в воде ионов Са2+ и Mg2+. Временную жесткость придают воде гидрокарбонатные и карбонатные соли кальция и магния, выпадающие при кипячении воды в осадок.
Постоянная жесткость
Постоянную жесткость определяют ионы Са2+ и Mg2+, оставшиеся в воде после кипячения. Жесткость воды выражается в миллиграмм-эквивалентах кальция и магния на 1 л воды. 1 мг-экв жесткости соответствует содержанию 20,04 мг/л Са2+ или 12,16 мг/л Mg2+ .
По степени жесткости выделяют: очень мягкие воды — до 1,5 мг-экв/л, мягкие — 1,5-3, умеренно жесткие — 3-6, жесткие — 6-9, очень жесткие — свыше 9 мг-экв/л. Жесткие воды плохо мылятся, дают накипь в котлах, не пригодны для питья.
Общая минерализация воды — это суммарное содержание в воде солей, газов и коллоидов, приближенно она равна массе сухого остатка, который определяется путем выпаривания воды в термостате при температуре 105-110оС; выражается в г/л или в промиллях — обозначение о/оо, (1 г/л=1 о/оо).
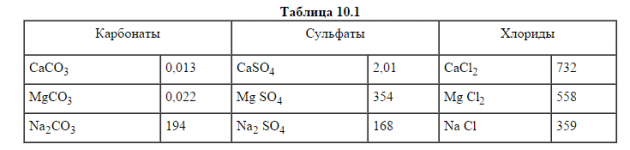
Максимально возможное содержание растворённых веществ в подземных водах зависит от предела их растворимости, который в свою очередь определяется содержанием в воде других солей и газов, а также температурой. Растворимость наиболее распространенных солей в дистиллированной воде при температуре 18°С в г/л приведена в табл. 10.1
Таблица 10.1
Растворимость СаСО3 (кальцит) в воде, насыщенной углекислым газом, может возрасти на два порядка. Растворимость СаSO4 (ангидрит) в присутствии NaCl возрастает в четыре раза, а вода, содержащая MgCl2, практически его не растворяет. При увеличении температуры от 0 до 60оС растворимость Na2СО3 возрастает более чем в 6 раз, Na2SO4 — в 9 раз.
Общая минерализация
По общей минерализации природные воды подразделяются: до 1 г/л — пресные (0-0,2 г/л — ультрапресные), 1-3 — слабосолоноватые, 3-10 — сильносолоноватые, 10-35 — соленые, более 35 г/л — рассолы.
Общая минерализация природных вод изменяется в широких пределах: от нескольких десятков миллиграммов на литр до 600 г/л и выше. Минерализация вод Мирового океана 35 г/л.
Химический анализ подземных вод производят для определения содержания отдельных компонентов, выполняют его в стационарных и полевых гидрохимических лабораториях. Для характеристики состава и свойств воды существует четыре типа химических анализов подземных вод: полевой, сокращенный, полный и специальный.
Полный анализ включает определение физических свойств, рН, Cl-, , , , Na+, K+, Ca2+, Mg2+, Fe2+, Fe3+, , , CO2, H2S, H2SiO3, окисляемости, сухого остатка, а также вычисление общей, карбонатной и постоянной жесткости и СО2 агрессивной.
Формы выражения результатов химического анализа воды — существуют: ионная, эквивалентная и эквивалент-процентная. Ионная форма выражает результаты непосредственного определения в ходе химического анализа каждого иона в весовых единицах (в граммах или миллиграммах), содержащегося в 1 л воды.
Поскольку ионы взаимодействуют между собой в строго определенных весовых отношениях (эквивалентах), во многих случаях удобнее выражать результаты химического анализа в эквивалентной форме. Один эквивалент иона Са2+, например, может вступить в реакцию только с одним эквивалентом.
Эквивалент
Эквивалентом называют число, показывающее, в каком весовом количестве данный ион вступает в соединение с другим ионом. Чтобы найти эквивалент того или иного иона нужно ионную массу этого иона разделить на его валентность. Например: 1 мг-экв = 20,04 мг; 1 мг-экв мг.
Следовательно, при образовании ангидрита 20,04 мг Са2+ должно вступить в реакцию с 48,03мг . Чтобы выразить анализ воды в эквивалентной форме, содержание каждого иона в 1 л воды, взятое в ионной форме (в г/л), нужно разделить на эквивалент данного иона. Например, если вода содержит 100,2 мг/л Ca2+ , то это составит 100,2 : 20,04 = 5 мг-экв Ca2+.
Эквивалентная форма выражения химического анализа дает возможность выяснить количественные соотношения содержащихся в воде ионов. Заметим, что число мг-экв катионов строго равно числу мг-экв анионов. Для получения эквивалент-процентной формы принимают сумму мг-экв анионов и сумму мг-экв катионов, содержащихся в 1 л воды, каждую порознь за 100 % и вычисляют процентное содержание каждого аниона (катиона).
Пересчет результатов анализа воды в эквивалент-процентную форму производится для удобства сопоставления вод различной минерализации и более ясного представления о соотношениях ионов одной и той же воды.
Классификация подземных вод по химизму выделяет три класса вод по преобладанию одного из главных анионов — классы гидрокарбонатный (и карбонатный вместе), сульфатный и хлоридный. Далее каждый класс делится на три группы по преобладающему главному катиону — кальциевую, магниевую и натриевую (совместно с калиевой). Дальнейшее деление на типы вод производится по характерным соотношениям эквивалентных содержаний некоторых главных ионов.
Способ выражения
Способы выражения химических анализов включают графические и числовые. Для графического изображения химического анализа воды используют различные геометрические фигуры, наибольшая наглядность получается при применении двух треугольников: по сторонам одного из них откладывают содержание анионов в эквивалент-процентной форме, по сторонам другого — катионов.
Компактном выражением химического состава воды является форма записи Курлова: содержание анионов и катионов в эквивалент-процентной форме записывается в виде псевдодроби в убывающем порядке, в числителе — анионы, в знаменателе — катионы.
Слева от дроби приводятся: М – общая минерализация – в г/л, содержание газов в г/л и микрокомпонентов в мг/л. Справа от дроби полезно указать рН, температуру, а если вода взята из источника, то и его дебит. Ионы, содержание которых в воде менее 10 %, часто не указываются, в связи с чем суммарное содержание ионов в рассматриваемой форме записи всегда менее 100 %.
Например, химический состав широкоизвестной минеральной воды Нарзан (г. Кисловодск) СО21,9 М 3,9 — сильно солоноватая, гидрокарбонатная натриево-кальциевая вода, содержащая углекислый газ.
Результаты гидрохимических исследований используют при построении гидрохимических карт и профилей, которые позволяют наглядно отобразить изменение химического состава подземных вод в пространстве земных недр.
Гидрохимическая зональность подземных вод — грунтовых и артезианских различная.
Для грунтовых вод характерна широтная зональность, которая определяется климатом и, особенно, степенью увлажнения территории, глубиной вреза речной сети, а также составом пород и их водопроницаемостью. В областях избыточного увлажнения, благодаря, обычно, хорошей проницаемости залегающих с поверхности пород, обильному питанию атмосферными осадками и дренирующей роли речных долин, озёрных котловин и др., происходит интенсивное движение грунтовых вод.
Водовмещающие породы
Водовмещающие породы хорошо промыты — легкорастворимые соли из них вымыты, в связи с чем современные грунтовые воды по общей минерализации пресные, а по химическому составу — гидрокарбонатно-кальциевые.
В сухих степях, полупустынях и пустынях, где вследствие малого количества осадков и интенсивного испарения, а также отсутствия естественного дренажа, грунтовые воды засолоняются, преимущественное распространение имеют солоноватые воды пестрого химического состава с преобладанием хлоридов и сульфатов, а из катионов Na (K) и Mg.
Для артезианских бассейнов характерна вертикальная зональность.
Верхняя зона — свободного водообмена, находится под воздействием современных климатических факторов, в сфере влияния эрозионного вреза речной сети, в результате чего обеспечивается дренаж водоносных горизонтов. Воды этой зоны преимущественно пресные, гидрокарбонатно-кальциевые, в засушливых районах — слабосолоноватые, сложного состава.
Средняя зона – затруднённого водообмена, находится ниже предыдущей. Водоносные горизонты имеют отдаленную связь с областями питания и разгрузки. Движение подземных вод происходит медленно, дренаж затруднён, влияние оказывают лишь вековые изменения климата. Преобладают солоноватые сульфатно-хлоридные магниево-натриевые воды.
Нижняя зона – чрезвычайно затрудненного водообмена, охватывает глубоко залегающие водоносные горизонты. В которых скорости движения воды исключительно малы, дренаж очень слабый, почти отсутствует. Воды соленые и рассолы, состав — хлоридно-натриевый.
Отмечаются также изменения артезианских вод по мере удаления от области питания. Минерализация — от пресных до соленых, химический состав — от гидрокарбонатных, через сульфатные к хлоридным.
Оценка качества воды
К подземным водам, используемым для различных нужд — хозяйственно-питьевых, технических, орошения полей и др., предъявляются разные требования к их качеству, что регламентируется ГОСТом. Требования к качеству воды для централизованного хозяйственно-питьевого водоснабжения следующие.
Вода должна быть бесцветной, прозрачной, не иметь неприятного запаха и вкуса, температура должна быть в пределе 5-15° С. Общая минерализация воды должна быть не более 1 г/л, общая жесткость — не более 7 мг-экв/л, рH — в пределах 6-9. Ограничивается содержание следующих главных анионов: — не более 500 и Cl — не более 350 мг/л.
Предельно допустимое содержание некоторых второстепенных ионов и микрокомпонентов (в мг/л): цинка — 5, фосфатов — 3,5, фтора — 1,5, меди — 1, алюминия — 0,5, железа — 0,3, марганца — 0,1, свинца — 0,1, мышьяка — 0,05, урана – 5Ч10-2, радия – 5Ч10-8 и др. Колитест — 3 ( не более трех кишечных палочек в 1 литре воды).
Агрессивность подземных вод. Подземные воды оказывают разрушающее воздействие на материалы, применяемые в строительстве, — бетон, металл и др., называемое агрессивностью.
Особую актуальность при возведении зданий и сооружений и их эксплуатации имеет агрессивность подземных вод по отношению к бетону, в виду его широкого применения. Выделяют пять видов агрессивного воздействия вод по отношению к бетону.
Агрессивность выщелачивания выражается в растворении водой карбоната кальция, входящего в состав бетона. Это происходит тогда, когда намного меньше количества равновесной свободной углекислоты СО2 . Вода считается агрессивной при содержании менее 1,05 мг-экв/л.
Углекислотная агрессивность
Углекислотная агрессивность обусловлена растворением карбонатов бетона агрессивной СО2. Часть свободной углекислоты, содержащейся в воде, идет на растворение карбоната кальция цемента и называется агрессивной углекислотой.
Другая, называемая равновесной углекислотой, остается в растворе и удерживает в растворе бикарбонат кальция. Если в воде имеется избыток свободной углекислоты по сравнению с равновесной, то при соприкосновении ее с кальцитом происходит реакция:
СаСО3 + 2Н2СО3 Û Са2+ + + 2
Этот процесс обратим и вправо до конца не доходит.
Общекислотная агрессивность связана с содержанием в воде свободных ионов Н+ и характерна для кислых вод. Для различных бетонов вода считается агрессивной при рН менее 4,0-6,5.
Сульфатная агрессивность обусловлена взаимодействием сульфатов, растворенных в воде, с карбонатом кальция бетона. В результате образуется гипс и сульфоалюминат кальция (3СаОЧАl2О3Ч3СаSO4). Образование этих солей в порах бетона сопровождается резким увеличением их объема, что приводит к разрушению бетона.
Вода начинает считаться агрессивной по отношению к обычному бетону при содержании более 250 мг/л (учитывается также наличие и некоторых других солей).
Магнезиальная агрессивность
Магнезиальная агрессивность проявляется при высоком содержании в воде иона Mg2+ (и ). Воздействие ее на бетон аналогично сульфатной агрессии.
Для железных конструкций, труб, насосов и др. опасна кислородная агрессивность, — растворённый в воде кислород вызывает коррозию металла. Вредны и кислые воды с низким значением рН.
Основные сведения по динамике подземных вод
Виды движения подземных вод
Различают два вида движения воды — ламинарное — параллельно-струйное и турбулентное, характеризующееся пульсацией и перемешиванием струй. Движение подземных вод в природных условиях обычно ламинарное.
Движение гравитационной воды в порах и трещинах горных пород в условиях полного насыщения их водой — в водоносном горизонте — называют фильтрацией. Совершается оно под влиянием разности напоров или уровней и происходит в направлениях близких к горизонтальному.
Реальное движение воды в горных породах происходит через систему сообщающихся между собой пор и трещин разных размеров и направлений и имеет сложный характер в силу постоянной изменчивости пути и скорости движения, в связи с чем движение воды рассматривается обобщенно.
Массу движущейся подземной воды называют фильтрационным потоком. В естественных условиях фильтрационные потоки обычно плоские, на участках водозаборов — радиальные. Движение воды в фильтрационном потоке может быть установившимся, когда все характеристики потока — мощность, напорный градиент. Расход воды и скорость фильтрации в рассматриваемом сечении не изменяются во времени, и неустановившимся, когда они переменны.
Движение подземных вод в природных условиях, строго говоря, всегда является неустановившимся. Однако в большинстве случаев изменение приведенных характеристик потока во времени незначительно и при решении практических задач этим можно пренебрегать.
Движение подземных вод называют равномерным, когда скорость фильтрации во всех сечениях потока одинаковая, и неравномерным, если скорость движения меняется по длине потока. В условиях не полного насыщения горных пород водой — в зоне аэрации, движение гравитационной воды (просачивание) происходит вертикально вниз и называется инфильтрацией.
Основной закон фильтрации
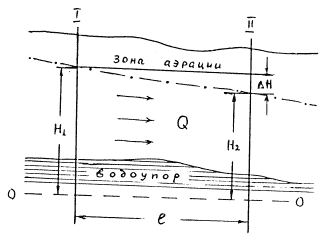
Для ламинарного установившегося движения подземных вод французский гидравлик А. Дарси экспериментальным путем установил, что расход воды, проходящий через любое поперечное сечение подземного потока, прямо пропорционален проницаемости горных пород, площади сечения и изменению напора (в случае артезианских вод) или уровня (грунтовые воды рис. 10.5) на рассматриваемом пути фильтрации:
(1)
Q — расход фильтрационного потока, т.е. количество воды, протекающей через данное поперечное сечение потока в единицу времени, м/сут.;
k — коэффициент фильтрации, характеризующий водопроницаемость пород, зависит от физических свойств породы и воды, м/сут;
— площадь поперечного сечения фильтрационного потока, м
— изменение напора или уровня на длине пути фильтрации, м;
L — длина пути фильтрации, м.
Отношение представляет собой напорный градиент или уклон и обозначается буквой J, величина безразмерная.
Рис. 10.5. Продольный разрез фильтрационного
потока безнапорных вод
Введя обозначение напорного градиента в уравнение (1) получим: Q = k (2) — выражение основного закона фильтрации через расход воды.
Скорость фильтрации
Скорость фильтрации (V) может быть охарактеризована количеством воды, протекающем в единицу времени (расходом) через единицу площади поперечного сечения фильтрующей горной породы: (3), размерность её м/сут.
Если в уравнении (2), обе части равенства разделим на , то получим еще одно выражение скорости фильтрации: V = kJ (4), которое показывает, что скорость фильтрации прямо пропорциональна первой степени напорного градиента. Отсюда этот закон и получил название линейного закона фильтрации.
Линейный закон фильтрации справедлив для движения воды в горных породах в широком диапазоне скоростей фильтрации. Однако при достижении напорным градиентом значений, называемых критическими, происходит нарушение ламинарного режима и переход к турбулентному.
Для движения воды в сильно трещиноватых скальных породах при турбулентном режиме А. А. Краснопольский установил следующую зависимость между скоростью фильтрации и напорным градиентом: (5) .
Допуская существование режима, переходного между ламинарным и турбулентным, Смрекер предложил следующую обобщенную зависимость скорости фильтрации от напорного градиента: , где I<m<2. (6)
Напорные градиенты
Критические напорные градиенты и критические скорости фильтрации находятся в обратной зависимости от величины пор и трещин в горных породах. Т.е. чем крупнее поры или трещины, тем при меньших значениях напорный градиент или скорость станут критическими.
Если провести такой искусственный прием — в уравнении V = kJ принять величину J равной 1, то получим V = k. Это дает возможность определить коэффициент фильтрации как скорость фильтрации при напорном градиенте равным единице. Коэффициент фильтрации, следовательно, имеет размерность скорости и выражается обычно в м/сут.
Искусственность этого приема заключается в том, что в природе такой крутой напорный градиент или уклон, практически не бывает — при уклоне равном единице, уровень грунтовых вод проходит под углом 45° к горизонту.
Особенностью коэффициента фильтрации пород, в отличии от других грунтовых характеристик, является громадный диапазон его значений. И растянутый более чем на пять порядков.
Средние значения коэффициента фильтрации наиболее распространенных рыхлых пород следующие: глина — менее 0,001, суглинок — 0,05-0,1, супесь — 0,1-0,5, песок пылеватый — 0,5-1, песок мелкозернистый — 1-5, песок среднезернистый — 5-20, песок крупнозернистый — 20-50, гравий с песчаным заполнителем 50-150, галечник с песчаным заполнителем — 50-500, галечник без заполнителя — более 500 м/сут.
Следует иметь в виду, что в рыхлых породах величину коэффициента фильтрации определяют 10 % самых мелких частиц, слагающих породу. Гравий и галечник с глинистым или суглинистым заполнителем обладают низкой фильтрационной способностью.
Скальные породы имеют такой же большой диапазон значений коэффициента фильтрации — от практически водонепроницаемых до 1000 и более м/сут в зависимости от трещиноватости, тектонической раздробленности и закарстованности.
Скорость фильтрации
Скорость фильтрации V, приведенная выше, не представляет собой реальную скорость движения воды в порах и трещинах горных пород, так как при ее определении расход воды подземного потока отнесен ко всей площади поперечного сечения, которая в основном занята минеральной частью породы, а поры и трещины составляют лишь незначительную долю.
Однако, несмотря на то, что скорость фильтрации является условной скоростью, именно она участвует в подавляющем числе фильтрационных расчетов. Чтобы получить действительную скорость движения воды в порах и трещинах фильтрующей породы, нужно расход воды отнести не на всю площадь поперечного сечения потока, а только на ту ее часть, которая занята порами и трещинами.
Учитывая еще, что часть пор и тонких трещин в породах занята тончайшими пленками воды, прочно удерживающихся капиллярными и молекулярными силами и не участвует в токе воды, для получения действительной скорости движения воды (U). Расход фильтрующейся воды надо отнести не к общей, а к так называемой эффективной или динамической пористости (n0), которая фактически проводит воду и всегда меньше общей пористости (n): . (7)
Соотношение между скоростью фильтрации и действительной скоростью движения подземных вод имеет вид V = Un0. (8)

Комментарии к записи «Физические свойства подземных вод»
Комментариев пока нет, но вы можете стать первым